Bovenstaande titel kan raadselachtig klinken, maar celbioloog Peter De Waele verklaart hem: dankzij het baanbrekende werk van biotechbedrijf Mablink Bioscience, kunnen antibody drug conjugates (ADC's) voortaan bogen op een hogere drug-antibody ratio (DAR). Het bedrijf heeft daarvoor zopas steun ontvangen van de Stichting Fournier-Majoie.
...
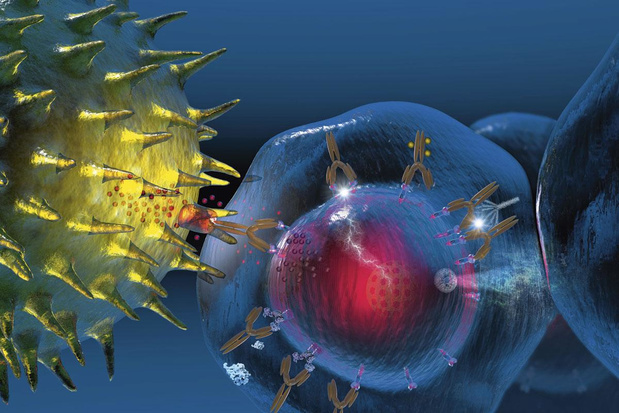
Het concept van de ADC's bestaat al een paar decennia", zegt Peter De Waele, die als consulent optreedt bij de Stichting Fournier-Majoie. "Ikzelf heb mijn doctoraatsthesis gewijd aan recombinante antilichamen. Toen al wilden we geneesmiddelen koppelen aan antilichamen, die in het lichaam doelgericht hun weg naar een bepaald celtype zouden vinden. Op die manier kon een geneesmiddel specifiek worden afgeleverd aan tumorcellen." Gaandeweg hebben een aantal technologische innovaties ervoor gezorgd dat ADC's de overstap naar de klinische praktijk maakten. "De belangrijkste daarvan is naar mijn mening de verbeterde kwaliteit van de recombinante antilichamen", vervolgt de Gentse celbioloog. "De specificiteit en affiniteit namen toe, onder andere met de komst van de monoklonale antilichamen. De hogere specificiteit deed de bijwerkingen afnemen, de hogere affiniteit versterkte het therapeutisch effect. Een verdere vooruitgang was dat de muisantilichamen plaats ruimden voor de gehumaniseerde en - beter nog - de humane antilichamen, zodat het risico van een immuunreactie tegen het recombinante antilichaam sterk werd beperkt. Ook beschikken we vandaag over meer gegevens rond de expressie en eigenschappen van specifieke antigenen ter hoogte van de tumorcellen. En eventueel ook in gezonde cellen, wat van belang is in verband met de bijwerkingen."De eerste ADC kwam op de markt in 2010 als behandeling voor acute myeloïde leukemie. Intussen is een hele reeks antilichamen ontwikkeld, voornamelijk tegen de vloeibare tumoren (leukemie, lymfoom, enzovoort). Sinds een tweetal jaar komen ook de vaste tumoren aan bod. Men spitst zich hier momenteel vooral toe op borstkanker, met inbegrip van triple-negatieve borstkanker. Dat is een moeilijker register, omdat ADC's relatief grote moleculen zijn en daardoor minder vlot in vaste tumoren doordringen.Peter De Waele: "Men slaagt er stilaan in dat op te vangen door het gebruik van antilichamen met een preciezere affiniteit. Ook de kwaliteit van de linkers is verbeterd. Een linker is een moleculaire structuur die het antilichaam koppelt aan het antikankergeneesmiddel sensu stricto. Er bestaan 'knipbare' linkers, die in de cel worden doorgeknipt, bijvoorbeeld door proteasen. Knipbare linkers zijn geschikt voor ADC's die via een endosoom in de kankercel worden geïnternaliseerd. Een goed knipbare linker stelt gemakkelijk het geneesmiddel vrij in het intracellulaire midden. En de ene linker doet dat het wat dat betreft al beter dan de andere. Voor de volledigheid zeg ik er toch nog bij dat niet alle linkers knipbaar hoeven te zijn. Het principe van de ADC wordt namelijk ook gebruikt om radiotherapie zeer lokaal naar de kankercel te brengen. In dat geval werkt de behandeling aan het celoppervlak, en moet de radioactieve molecule net niet van het antilichaam losgekoppeld worden." "Als ze deskundig worden toegediend, betekenen ADC's een onmiskenbare meerwaarde voor de patiënt. Vandaar dat er zowel vanuit de bedrijven als vanuit de wetenschap veel belangstelling is voor deze middelen. Hun ontwikkelingstraject blijkt succesvol te zijn. Globaal bedraagt de kans dat een geneesmiddel zich vanuit het preklinische stadium een weg baant naar de klinische praktijk minder dan 1%. Voor ADC's is dat beduidend meer. Momenteel zijn zowat 600 tot 700 klinische en preklinische studies aan de gang om de klasse van de ADC's verder uit te bouwen." "Het aantal moleculen van het kankergeneesmiddel dat men aan één antilichaam koppelt, kan variëren naargelang de gebruikte methode", weet Peter De Waele. "Men noemt dat de drug-antibody ratio (DAR). Neem trastuzumab- deruxtecan (Enhertu), een middel dat ik zou durven bestempelen als de meest interessante en succesvolle ADC die vandaag op de markt is. Welnu, trastuzumab- deruxtecan heeft een DAR die varieert tussen 2 en 4. Hieruit blijkt al meteen dat het product niet homogeen is, meer bepaald, dat het aantal moleculen van het geneesmiddel per antilichaam varieert." "Anders liggen de zaken met het polymeer dat gebruikt werd door Mablink Bioscience bij de productie van ADC's. Het gaat om een monodispers polysarcosine met een homogeen moleculair gewicht. Daardoor is ook de DAR homogeen. Dat is belangrijk om verschillende ADC's met elkaar te kunnen vergelijken: in plaats van een marge beschikt men over een eenduidig getal. Bovendien zorgt dit polysarcosine, in tegenstelling tot de meeste andere ADC's, voor een afscherming van het geneesmiddel, met een betere oplosbaarheid tot gevolg en daardoor minder aspecifieke interacties met gezonde cellen." Maar er is meer: "Het polysarcosine vormt rond het geneesmiddel een cocon die het cytotoxische effect bijzonder efficiënt afschermt van de buitenwereld en zodoende schade aan gezonde weefsels/ cellen sterk beperkt. Dat verklaart waarom men niet alleen een constant aantal moleculen aan het recombinante antilichaam kan binden, maar ook een hoger aantal moleculen (hogere DAR). Via binding van één recombinant antilichaam aan de tumorcellen, wordt dus een hogere dosis antikankergeneesmiddel afgeleverd. Een hogere dosis antikankergeneesmiddel gaat hier gepaard met een lager risico op bijwerkingen. Met andere woorden, de therapeutische index wordt ruimer. Dat geeft meer bewegingsvrijheid bij de doseren van de behandeling, terwijl men de veiligheid vrijwaart." "Dankzij het gebruik van het polysarcosine kan men nu ADC's ontwikkelen die vroeger wegens hun eigenschappen en ook hun bijwerkingen onbruikbaar waren." En Peter De Waele concludeert: "De nieuwe generatie ADC's gekoppeld aan polysarcosine werd tot nog toe alleen gebruikt in preklinisch onderzoek, maar de resultaten zijn beloftevol. Het is nu uitkijken naar de resultaten van klinische studies. Ik wil er nog graag aan toevoegen dat de polysarcosinemantel mogelijk uitzicht heeft op een breder toepassingsgebied. Er zijn wel meer moleculen, waaronder cytokines, die worden toegediend in een cocon, om de halfwaardetijd te verlengen. Een voorbeeld daarvan is peginterferon."