Tijdens het ESMO Education Weekend van 16-18 oktober 2020 werden nieuwe behandelingsopties voor gastro-intestinale stromale tumoren (GIST) belicht. Daarbij ging aandacht uit naar nieuwe geneesmiddelen, maar ook naar het meer doeltreffend maken van bestaande behandelingen via een gepersonaliseerde aanpak.
...
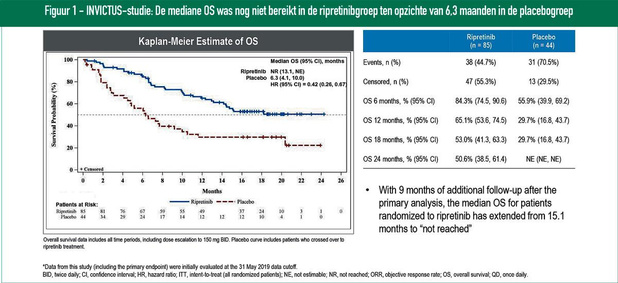
Dr. Suzanne George, van het Dana Farber Cancer Institute in Boston, startte met een overzicht van de tyrosinekinaseremmers (TKI's) die al enige jaren beschikbaar zijn voor de behandeling van geavanceerde GIST. Deze zijn gericht tegen mutaties in KIT, die voorkomen bij het merendeel van de GIST. Als eerstelijnsbehandeling wordt imatinib gebruikt, een TKI met een nauwe werking. Het grootste deel van de patiënten ontwikkelt echter na 18 tot 24 maanden resistentie als gevolg van secundaire mutaties in KIT. In tweede lijn wordt sunitinib gebruikt, een TKI die een breder spectrum heeft. De mediane PFS na behandeling met sunitinib bedraagt ongeveer zes maanden. Als derdelijnsbehandeling is er regorafenib, met een nog breder spectrum van activiteit; de mediane PFS bedraagt hier ongeveer vijf maanden. Alhoewel de incrementele overleving gestegen is via deze behandelingen blijft er ruimte voor verbetering. Het onderzoek naar nieuwe KIT-inhibitoren loopt dan ook verder. Eén daarvan is ripretinib, een breedspectrum KIT-inhibitor, die quasi alle mutante vormen van KIT lijkt te inhiberen. Ripretenib werd als vierdelijnsbehandeling of verder onderzocht versus placebo in de fase 3-studie INVICTUS. De primaire analyse in 2019 toonde een PFS van 6,3 in vergelijking met 1,6 maanden in de placebogroep (1). Data van een bijkomende opvolging van negen maanden werden onlangs voorgesteld en confirmeerden deze verbeterde PFS (2). De mediane OS was nog niet bereikt in de ripretinibgroep ten opzichte van 6,3 maanden in de placebogroep (figuur 1). Alvast in de VS is ripretinib goedgekeurd als een nieuwe optie voor behandeling vanaf de vierde lijn van GIST. Verder onderzoek moet uitwijzen welke moleculaire subgroepen het meeste baat hebben bij de behandeling. Ook stelt zich de vraag welke mechanismen ervoor verantwoordelijk zijn dat er toch ook bij deze breedspectrum-TKI nog steeds resistentie optreedt. Een andere KIT-inhibitor waarvoor onlangs positieve resultaten werden behaald, is avapritinib. Deze KIT-inhibitor is specifiek voor KIT exon 17 en de PDGFRA D842V-mutatie. Patiënten die de D842V-mutatie dragen (ongeveer 5%) tonen een primaire resistentie tegen de reeds goedgekeurde TKI's. De primaire analyse van de fase 1-studie NAVIGATOR toonde een ORR van 84% en een PFS van 81% na 12 maanden (figuur 2) (3). Op basis van deze data werd avapritinib zowel in de VS als Europa goedgekeurd voor de behandeling van GIST met een D842V-mutatie. Een fase 3-studie (VOYAGER) waarin avapritinib in derde of vierde lijn vergeleken wordt met regorafenib bij moleculair niet-geselecteerde patiënten is aan de gang. Dr. George besloot dat er verdere vooruitgang geboekt wordt voor de behandeling van GIST, maar resistentie aan TKI's blijft een uitdaging. Verwacht kan worden dat we in de toekomst naar combinatiebehandelingen zullen gaan van KIT-inhibitoren met geneesmiddelen tegen andere nieuwe targets. Dr. Neeltje Steeghs, van het Nederlands Kanker Instituut, besprak opties om de langetermijnsbehandeling van GIST-patiënten met TKI's te verbeteren. Op basis van klinische studies blijkt dat de cumulatieve mediane PFS dankzij de huidige behandelingen meer dan drie jaar bedraagt; 'real life'-studies toonden zelfs een overlevingstermijn van 30-40 maanden na eerstelijnsbehandeling. In de praktijk blijkt dat ongeveer 10% van alle patiënten met metastatische GIST na tien jaar nog TKI-responsief zijn. Het is dan ook belangrijk om te begrijpen wie deze patiënten zijn en om de werkzaamheid van de TKI's te optimaliseren. Data van patiëntenregisters kunnen daarbij helpen. Dr. Neels gaf als voorbeeld het Nederlandse GIST-register, waarin inmiddels over een periode van meer dan tien jaar data van 1.200 patiënten verzameld zijn. Data vanuit dit register lieten toe om betere inzichten te krijgen in de waarde van therapeutic drug monitoring (TDM) of precision dosing bij GIST. De keuze voor de dosering van een geneesmiddel stamt meestal af van fase 1-studies bij een klein aantal patiënten, ze is vaak meer gedreven door het veiligheidsprofiel dan door de werkzaamheid. Het is echter geweten dat de variabiliteit in blootstelling na inname van orale kankermedicijnen erg kan schommelen tussen individuen. Voor imatinib werd aangetoond dat patiënten met een minimale plasmawaarde (Cmin) ? 1.100 ng/ml een significant langere PFS hebben (30,6 vs. 11,3 maanden) (4). Ook voor sunitinib werd een hogere blootstelling (? 37,5 ng/mL) geassocieerd aan een langere TTP (5). Data van het Nederlandse register toonden dat bij de gebruikelijke vaste dosering voor imatinib 32,4% van de patiënten een blootstelling onder de doelstelling hadden in 75% van de stalen (6). Voor sunitinib vond men dat 33% van de patiënten een Cmin < 37,5 ng/ml had (7). Recent werd een retrospectieve studie uitgevoerd bij patiënten die met imatinibbehandeling startten aan een dosis van 400 mg en voor dewelke PK-metingen voorhanden waren (8). Van de 169 patiënten bleken er 126 (75%) een plasmaconcentratie onder de Cmin te hebben. Bij degenen die geen toxiciteit vertoonden (78 patiënten) werd de imatinibdosis op basis van de PK-parameters verhoogd naar 600 mg of 800 mg; bij 63% leidde dit tot een blootstelling boven de Cmin. In Nederland beschouwt men TDM inmiddels als deel van de standaardbehandeling. Het Nederlandse Kanker Instituut biedt op basis van hun ervaringen praktische aanbevelingen aan voor precision dosing voor imatinib en sunitinib bij GIST-patiënten (e-mail: TDM@nki.nl).