Clonale Hematopoiesse wordt als pre-leukemische fase in context geplaatst. CH wordt ook vastgesteld na succesvolle behandeling bij langdurige AML overlevers.
...
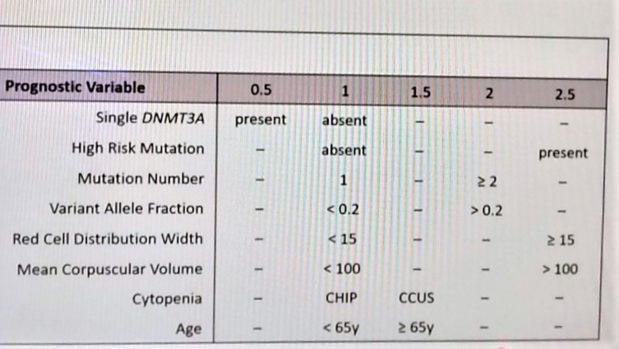
Clonale Hematopoiese (CH) en de origine van leukemieSomatische mutaties komen vaak voor tijdens onze levensloop, ook in het beenmerg, resulterend in naar schatting 25 tot 100 mutaties per Hematopoietisch Stamcel gen tegen de leeftijd van 70. Deze veroorzaken CH, zowel met als zonder leukemische kandidaat 'drivers' zoals het meest voorkomende DNMTA3. Het percentage van dergelijke Variant Allel Frequenties (VAF) neemt toe met de leeftijd en afhankelijk van de gevoeligheid van de methodologie en de grenswaarde (0.5%) stijgt dit tot hoge prevalenties over de 80%!Enkele definities: CHIP en CCUS. CHIP, 'CH met Indetermineerbaar Potentieel' wordt gedefinieerd als somatische mutatie in myeloide maligniteit 'driver' genen met een VAF>2% maar met nog normale bloedcel aantallen. CCUS is 'CHIP mét klonale cytopenie met nog onzekere significantie', zonder verklaring én persisterend. Er is een duidelijk verschil tussen de betekenis van myeloide en lymfoide CH, M-CHIP of L-CHIP. L-CHIP stijgt nauwelijks met de leeftijd, M-CHIP springt vooruit tussen de leeftijd van 40 tot 70+, met in de top de zogenaamde DTA-mutaties: DNMTA3, TET2 en ASXL1. Bij M-CHIP vertoont de cumulatieve incidentie van myeloide maligniteiten een risico-index (HR: hazard ratio) van 7,5 over 10 jaren; L-CHIP resulteert in een HR van 4. Bij afwijkende aantallen bloedcellen wordt de HR van CH hoger, meer dan tienvoudig, binnen datzelfde tijdsinterval!Interessant is de associatie van CHIP met andere aandoeningen, zoals het verhoogd risico op hartinfarct en hersentrombose. De abnormale kloon van gemuteerde cellen laat meer pro-inflammatoire cytokines vrij, en dit neem toe op hogere leeftijd. CHIP lijkt ook geassocieerd aan COPD, jicht en osteoporose... tot chronisch nierlijden en leverstoornissen! CHIP verdubbelt het risico op leveraandoeningen en zowel TET2- als JAK2-mutante CHIP verhoogt dit verder. Even een blik op de predictie van het verloop bij CHIP! De factoren met impact op het progressie risico bij CHIP omvatten: het specifieke getroffen genotype, de klonale complexiteit, de klonale omvang (VAF) én het rode bloedcel volume! Samen met enkele andere factoren bepalen deze het individuele risico. Er werd een risico score ontwikkeld: de CHRS, met drie onderscheiden risicogroepen: laag, intermediair en hoog. (slide 1). Volgens multivariant analyse verdeelt de HR zich dan per klasse als volgt: 3,3 , 37 en 348! Dezen correleren duidelijk met de 10-jaarsoverleving: 94 , 84 en 51%. Samengevat: CHIP komt vaak voor en neemt toe met de leeftijd. CHIP mutaties verhogen significant het risico op leukemie . Het progressierisico kan voorspeld worden in de CHRS.Langdurige AML overlevers "We steken veel moeite in het proberen begrijpen waarom patiënt sterven aan AML. Misschien kunnen we evenveel leren door het bestuderen van hen die actueel de ziekte overleefden!" (dr. Charles Schiffer, Buffalo, NY, USA, rond 2016)Bij AML patiënten (uit klinische studies) meer dan vijf jaar na hun diagnose en vrij van herval en zonder verdere behandeling, werd een Duitse cohorte studie uitgevoerd. De prevalentie van somatische comorbiditeiten werd vergeleken met de algemene populatie. De AML overlevers, met of zonder SCT, vertonen een 2x hoger risico op diabetes, een 3,5x hoger risico op hartfalen, een significant hogere prevalentie van nierfunctie aantasting maar geen hoger risico op coronair lijden. Hier volgen nog boeiende observaties bij de langdurig ziektevrije overlevers:- Hoge prevalentie van CH na AML: CH genvarianten bij 75% in de chemo-cohorte en 53% bij de SCT overlevers.- De AML aanpak moduleert het CH mutatie spectrum: DNMTA3 en TET2 vooral maar met TP53 en PPMD1D meer bij de chemo-groep.- De AML aanpak moduleert de leeftijdafhankelijkheid van CH: in de chemo-groep loopt deze op van 50% (jonger dan 50j) tot 86% (boven 70j); in de SCT-groep speelt de tijdsduur na SCT deze rol: 31% 5 jaar later, 75% na meer dan 15jaar.- CH associeert zich aan diabetes bij de SCT overlevers en aan secundaire kankers in de chemo-groep.