Volgens onderzoeken uitgevoerd aan de UCLouvain zouden bepaalde kankercellen gebruik maken van een nieuwe wijze van endocytose, waarin het membraaneiwit CD166 meespeelt, om te migreren en metastasen te vormen.
...
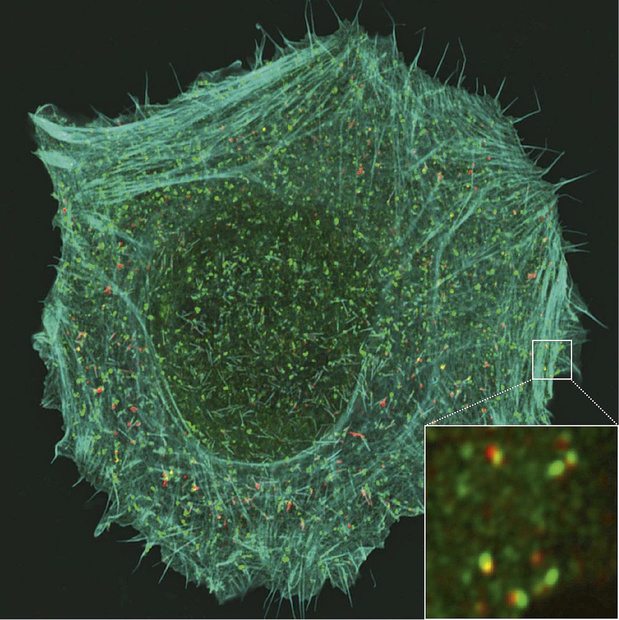
Binnen het Louvain Institute of Biomolecular Science Technology (LIBST) voert het laboratorium voor membraanbiologie onder de leiding van prof. Pierre Morsomme al enkele jaren onderzoek uit naar de rol en de ligging van membraanproteïnen. De biologische membranen die het intra- en het extracellulaire compartiment scheiden, vormen geen totaal ondoorlaatbare barrières. Hoe controleren de cellen de instroom van elementen vanuit het extracellulaire compartiment? De vorsers hebben hun onderzoeken hoofdzakelijk uitgevoerd op Saccharomyces cerevisiae (biergist) en humane cellen in cultuur. "Eén van de mechanismen die onze aandacht trekken, is endocytose", rapporteert prof. Morsomme. Bestanddelen van het plasmamembraan zoals lipiden en eiwitten, maar ook elementen van buiten de cel zoals toxines en virussen kunnen via endocytose in de cel geraken. Bij endocytose vormt het plasmamembraan een blaasje, dat de elementen opneemt en dan in de cel 'afzet'. "Op dat ogenblik kunnen er twee dingen gebeuren: ofwel worden de membraaneiwitten (dat is wat wij onderzoeken) in de lysosomen afgebroken ofwel worden ze tijdelijk in de cel opgeslagen en daarna gerecycleerd, d.w.z. dat ze dan terug naar het oppervlak van het plasmamembraan gestuurd worden om er een functie te vervullen", zegt Pierre Morsomme. Een mechanisme van endocytose dat al sinds tientallen jaren wordt onderzocht en goed omschreven is, is gebaseerd op clathrine. Lange tijd werd trouwens gedacht dat dit de enige vorm van endocytose is. Clathrine is een eiwit waarvan de structuur doet denken aan een steiger met drie in plaats van twee armen. Clathrine kan oligomeren vormen. Als er meerdere clathrinemoleculen samenklitten, vormt zich een soort kooi, die fysische druk zal uitoefenen op het plasmamembraan, waardoor het vervormt en een endocytosevesikel gaat vormen. Nu kennen we meerdere endocytoseprocessen die losstaan van clathrine, maar we weten nog niet of die meespelen in pathofysiologische situaties zoals kanker. Het laboratorium van het LIBST voert intensief onderzoek uit om 'nieuwe endocytosewegen' te detecteren en te beschrijven. Tegen die achtergrond heeft het laboratorium dankzij analyse van proteomics door massaspectrometrie een nieuw endocytosemechanisme ontdekt, dat van belang kan zijn in de oncologie en met name bij de vorming van metastasen. Die onderzoeken zijn in 2020 gepubliceerd in Nature Communications (1). De eerste auteurs van het artikel zijn Henri-François Renard, nu hoogleraar aan de UNamur, en François Tyckaert, vorser aan het LIBST. Pierre Morsomme beschrijft hoe zijn team te werk is gegaan. "We hebben clathrine in een aantal cellen geremd en we hebben dan geanalyseerd welke eiwitten in de cellen werden opgenomen in afwezigheid van clathrine in vergelijking met normale cellen. Zo hebben we een nieuw mechanisme van endocytose ontdekt en hebben we vastgesteld dat CD166, een van de eiwitten die in de cellen werden opgenomen, bijzonder interessant is." Dan zijn de researchers gaan onderzoeken welke eiwitten CD166 nodig heeft om in de cel te dringen in afwezigheid van clathrine. Ze hebben daarbij vooral gekeken naar endofiline-A3 van de familie van eiwitten met een BAR-domein. Die eiwitten zijn sikkelvormig, kunnen een kromming van het celmembraan bewerkstelligen en zo een fenomeen van endocytose in gang zetten. Meerdere laboratoria hadden al aangetoond dat endofiline-A2, een ander eiwit met een BAR-domein, meespeelt bij endocytose, meer bepaald bij de instroom van Shiga-toxine in de cel. De weg die CD166 in de cel voert en geregeld wordt door endofiline-A3, was echter nog niet bekend. De biologen hebben er zich bovendien rekenschap van gegeven dat endofiline-A3, een intracellulair eiwit, tijdens het endocytoseproces wordt bijgestaan door een extracellulair eiwit, meer bepaald galectine-8. "Naast CD166, endofiline-A3 en galectine-8 moeten we nog veel andere eiwitten ontdekken die daarbij meespelen. Mijn team probeert dat uit te spitten in samenwerking met Henri-François Renard van de UNamur, het laboratorium van Pierre van der Bruggen van de UCLouvain en het Institut Curie in Parijs", zegt prof. Morsomme. Het CD166-eiwit is geen onbekende, verre van. Het wordt sterk tot expressie gebracht door bepaalde kankers (borst-, long-, pancreaskanker, colorectale kanker, melanoom) en is trouwens een van de biomarkers van die kankers. We weten ook dat er een correlatie bestaat tussen de mate van expressie van CD166 bij die kankers en de prognose. De mechanismen die dat eiwit regelen, waren echter nog niet onderzocht. De groep van de UCL heeft die mechanismen geanalyseerd, wat interessante hypothesen heeft opgeleverd over de rol van CD166 bij metastasering en de interacties tussen de kankercellen en het immuunsysteem. Met gesofisticeerde microscopische technieken (TIRFM en lattice light sheet), die het Institut Curie heeft ontwikkeld, hebben de biologen van het LIBST CD166 kunnen onderzoeken. CD166 is een adhesiemolecuul in het membraan, waarvan de ligand een CD166-eiwit kan zijn of een CD6-eiwit van een andere cel. De vorsers vergelijken CD166 met een velcro, die ervoor zorgt dat de cellen van een gegeven structuur solidair blijven. Kankercellen zijn geen uitzondering op die regel. Ze vermenigvuldigen zich en klitten samen op de plaats van de primaire tumor, maar sommige migreren en gaan metastasen vormen. Bij analyse van kankercellen in cultuur en meer bepaald cellen van de 'onsterfelijke' HeLa-cellijn hebben de onderzoekers van het LIBST een interessante ontdekking gedaan. Maligne cellen waarvan het aantal CD166-eiwitten op het oppervlak van het plasmamembraan artificieel werd verlaagd door een geringere expressie van het gen dat codeert voor CD166, of door meer endocytose via overexpressie van endofiline-A3, blijken minder goed aan elkaar te kleven. "In aanwezigheid van CD166 kleven de tumorcellen beter aan elkaar en migreren ze minder. Als er weinig of geen CD166 is, gebeurt net het omgekeerde", vat prof. Morsomme het samen. Vandaar het idee dat sommige kankercellen de hoeveelheid CD166 op hun oppervlak zouden kunnen verlagen via endocytose, waardoor ze meer 'bewegingsvrijheid' krijgen en zouden kunnen loskomen en uitzaaien. "Dat zijn echter gegevens op basis van cellulaire modellen. We weten nog niets over het gedrag van kankercellen in een tumor", commentarieert het hoofd van het laboratorium. Om na te gaan of de aan CD166 gerelateerde endocytose echt meespeelt bij metastasering, moeten we studies uitvoeren op complexere modellen. "Bijvoorbeeld modellen van organoïden of modellen die in vivo fysiologisch relevant zijn. Dat kan ons laboratorium niet aan, daarvoor moeten we samenwerken met andere laboratoria", zegt Pierre Morsomme nog. Hoewel zuiver speculatief, zou het best kunnen dat er een voldoende hoeveelheid CD166 op het oppervlak van de kankercellen blijft zitten als we de endocytose remmen. Zo zouden we migratie van die cellen en vorming van metastasen kunnen verhinderen. We beschikken echter nog niet over een stof die de endofiline-A3-dependente endocytose remt. Anderzijds weten we dat een grote hoeveelheid CD166 correleert met de ontwikkeling van bepaalde tumoren. "Met andere woorden, overexpressie van CD166 zou de ontwikkeling van de tumor in de hand kunnen werken en een geringere expressie van CD166 zou de vorming van metastasen kunnen tegengaan", denkt prof. Morsomme. "Elke behandeling die daarop is gebaseerd, zou moeten stoelen op een zeer subtiel evenwicht. Op grond van onze huidige kennis is het nog te vroeg om te zoeken naar een geneesmiddel dat specifiek CD166 remt, ook al omdat dat eiwit een fysiologische rol speelt in normale cellen." Er bestaan echter nog andere adhesiemoleculen. De onderzoeker denkt dat we eerst moeten nagaan hoe die worden geëndocyteerd en geregeld, om een volledig beeld te krijgen van de wijze waarop tumorcellen aan elkaar kleven. "Dat zou een eerste stap naar een behandeling zijn", voegt hij eraan toe. De biologen van het LIBST denken verder dat CD166 zou kunnen meespelen bij de vorming van immuunsynapsen, meer bepaald de connecties tussen kankercellen en cellen van het immuunsysteem, vooral de CD8+ T-lymfocyten. Dat is de groep van de UCLouvain nu aan het onderzoeken. De hypothese is dat kankercellen CD166-moleculen zouden concentreren op de plaats waar ze in verbinding staan met andere cellen, teneinde hun samenhang met andere kankercellen te versterken en de plaatselijke tumorontwikkeling te bevorderen. "De CD166-eiwitten die zich elders op het plasmamembraan bevinden, zouden via endocytose in de cel worden opgenomen en dan weer naar het contactpunt worden gestuurd", legt Pierre Morsomme uit. "Dat proces is bevorderlijk voor de tumorgroei als het gaat om tumorcellen die aan elkaar kleven, maar zou dat niet zijn als ze een andere cel zoals een CD8+ T-lymfocyt zouden ontmoeten. Met andere woorden, het immuunsysteem zou CD166 kunnen gebruiken als wapen tegen de tumor." In voorkomend geval zouden we CD166 eventueel kunnen gebruiken in het kader van immunotherapie tegen kanker. Prof. Morsomme voegt er echter aan toe dat dit louter een speculatieve hypothese is."