Prof. Enriqueta Felip, hoofd van de thorax- en hoofd- & halskankerkliniek binnen het ziekenhuis Vall d'Hebron in Barcelona, presenteerde de resultaten van deze studie waarbij atezolizumab (atezo) vergeleken werd met de beste ondersteunende zorg (BSC) bij die groep van patiënten met een hoge PD-L1-expressie in het geval van niet-kleincellige longkanker (NSCLC) in stadium II-IIIA.
Subanalyse IMpower010
IMpower010 is de eerste fase III-studie met immunotherapie die in de adjuvante setting na een op platinum gebaseerde chemotherapie, een significante verbetering van de ziektevrije overleving (DFS) heeft aangetoond. Bij een interimanalyse vertoonde atezo een significant voordeel in DFS vs. BSC bij patiënten met een PD-L1-expressie in meer dan 1% van de tumorcellen (TC) (HR = 0,66; 95% BI: 0,50, 0,88). De grootste DFS-verbetering werd toen reeds gezien in de populatie met PD-L1 TC >50%. Prof. Felip presenteerde op ELCC een verdere analyse van deze populatie met NSCLC in stadium II-IIIA en PD-L1 TC ≥50% (1).
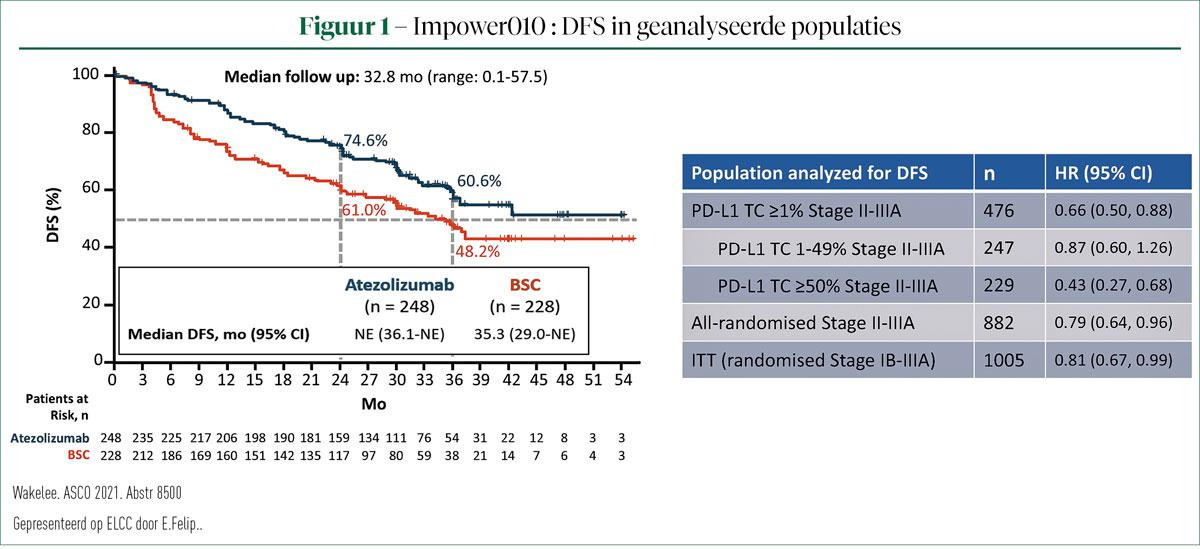
De IMpower 010-studie includeerde 1.280 patiënten met een NSCLC in stadium IB-IIIA, waarbij tumoren in stadium IB minstens 4 cm groot moeten zijn. Alle patiënten ondergingen eerst een lobectomie of een pneumonectomie en kregen eerst 1-4 cycli met een op cisplatinum gebaseerde chemotherapie. Vervolgens werden 1.005 patiënten gerandomiseerd naar 16 cycli atezo (1.200 mg q21d). Primaire eindpunten van de studie waren DFS zowel in de ITT-populatie (stadium IB-IIIA) en bij alle gerandomiseerde patiënten (stadium II-IIIA), maar ook bij de stadium II-IIIA-populatie met PD-L1 TC > 1%. Secundaire eindpunten waren de globale overleving (OS) in de ITT-populatie, DFS in de populatie in stadium II-IIIA en PD-L1 TC ≥50% en de 3-jaars en 5-jaars DFS in de drie populaties.
Deze subanalyse bekeek de populatie in stadium II-IIIA met PD-L1 TC ≥50%, met 115 patiënten in de atezo-arm versus 114 in de BSC-arm. Patiëntenkarakteristieken waren nagenoeg gelijk in beide armen en waren erg vergelijkbaar met de karakteristieken in de ITT-populatie. De mediane DFS in deze populatie werd nog niet bereikt in de atezo-arm versus 35,7 maanden in de groep die BSC kreeg. Na drie jaar zijn in de atezo-arm 73,8% van de patiënten nog steeds ziektevrij versus 48,6% in de controle-arm. Een verdere subanalyse toonde geen noemenswaardige verschillen in de onderzochte subgroepen. Dat geldt ook wanneer de patiënten met een EGFR/ALK+-mutatie worden geweerd uit de analyse. OS-gegevens in deze populatie zijn momenteel nog immatuur en een verdere follow-up is dan ook noodzakelijk. Bekijken we het patroon van herval, dan merken we dat het percentage locoregionaal herval nagenoeg gelijk is in beide groepen (13% in atezo-arm vs. 15% in BSC). Herval op afstand komt echter meer voor in de BSC-arm dan bij de patiënten die atezo kregen (9% in atezo-arm vs. 26% in BSC-arm). De tijd tot herval bedraagt 18,1 maanden in de atezo-arm versus 10,1 maand in de BSC-arm.
Het veiligheidsoverzicht van deze behandeling in de populatie in stadium II-IIIA en met PD-L1 TC ≥50% is vergelijkbaar met dat van de ITT-populatie. Prof. Felip wees erop dat geen graad 5-bijwerking genoteerd werd in de atezo-arm. Wel is het zo dat bij 19% van de patiënten de behandeling met atezo dient gestopt te worden als gevolg van een bijwerking.
Prof. Felip concludeerde dan ook dat deze resultaten een verdere bevestiging zijn van de positieve baten-risicobalans van een adjuvante behandeling met atezolizumab bij NSCLC- patiënten in een stadium II-IIIA en een 50% PD-L1-expressie (2).
Furmonertinib bij behandelingsnaïeve EGFR-gemuteerde NSCLC
Prof. Yuankai Shi (Beijing) presenteerde de data van de FURLONG-studie, een gerandomiseerde, dubbelblinde, multicentrische fase III-studie uitgevoerd in 55 Chinese ziekenhuizen. Furmonertinib (AST2818) is een selectieve epidermale groeifactorreceptor (EGFR)-tyrosinekinase-inhibitor (TKI) van de derde generatie, die zowel EGFR-sensibiliserende als T790M- resistente mutaties onomkeerbaar kan inhiberen (3). Deze studie includeerde 358 patiënten met een lokaal gevorderd of gemetastaseerd NSCLC waarbij een positieve EGFR-mutatie werd vastgesteld en die nog geen eerdere anti-tumorbehandeling gekregen hebben. Deze patiënten werden gerandomiseerd naar furmonertinib (FURMON) 80 mg dagelijks (QD) of naar gefitinib (GEF) 250 mg QD. De behandeling werd stopgezet bij ziekteprogressie, ondraaglijke toxiciteit of bij het opstarten van een nieuwe behandeling. Primair eindpunt van de studie is progressievrije overleving (PFS).
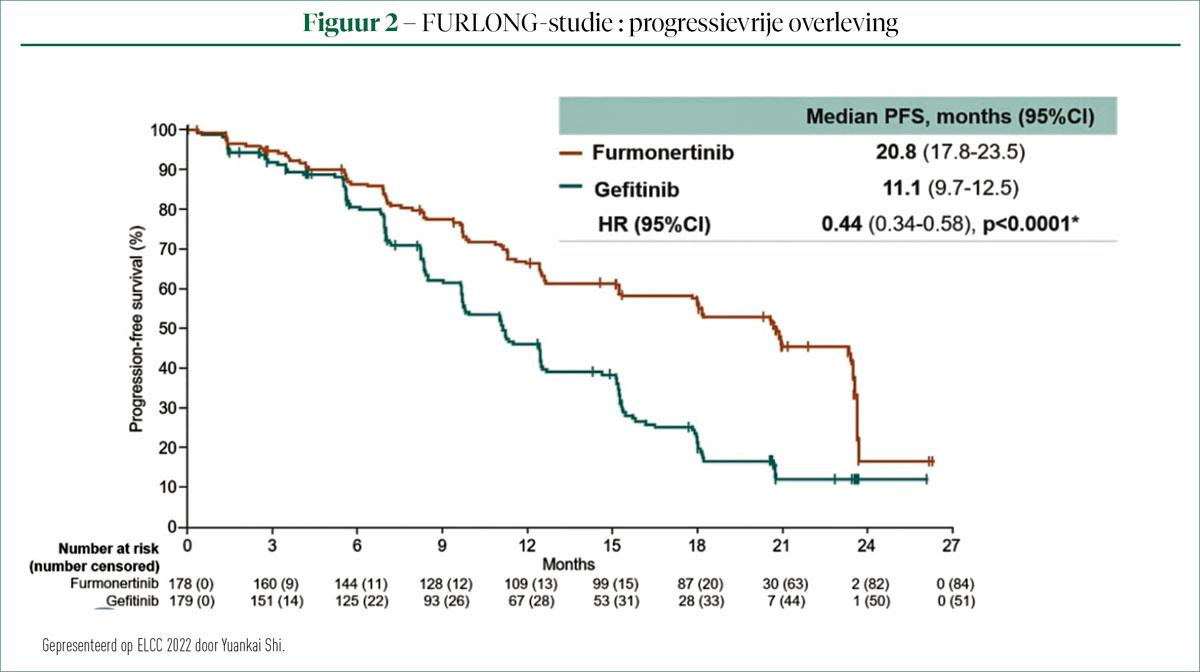
PFS, het primaire eindpunt van de studie was beduidend beter voor patiënten die behandeld waren met FURMON in vergelijking met GEF. Mediane PFS in de FURMON-groep bedroeg 20,8 maanden versus 11,1 voor patiënten die met GEF behandeld waren (HR = 0,44; BI: 0,34-0,58; P < 0,0001 ) (figuur 2). Een subgroepanalyse van deze PFS toonde een consistent voordeel voor FURMON over GEF in alle onderzochte subgroepen, inclusief die patiënten die CNS-metastasen vertonen (HR = 0,50, BI: 0,32-0,80).
Prof. Yuankai Shi besprak ook de secundaire eindpunten van de studie. Het objectieve responspercentage (ORR = complete respons (CR) + partiële respons (PR)) en het ziektecontrolepercentage (DCR= CR + PR + stabiele ziekte (SD)) was nagenoeg gelijk bij zowel FURMON als bij GEF. ORR bedraagt 89% in FURMON-groep vs. 84% in GEF-groep en DCR is 96% en 93% respectievelijk. De duur van de respons daarentegen toont opnieuw een voordeel voor de patiënten die FURMON kregen vs. GEF: 19,7 maanden versus 10,5 maanden (HR = 0,39, BI: 0,29-0,52). Ook de tijd tot progressie van de tumor was langer bij patiënten die FURMON kregen in vergelijking met zij die GEF kregen (20,9 maanden versus 11,2 maanden). Mediane OS was in beide groepen nog niet bereikt. Prof. Yuankai Shi maakte de opmerking dat in de groep die GEF als eerste behandeling kreeg, 43% nadien een derde generatie EGFR-TKI kreeg na progressie.

Bij het analyseren van de veiligheidsdata moeten we in acht nemen dat de mediane duur van behandeling met FURMON 18,3 maanden is versus 11,2 maanden met GEF. 11% van de FURMON-groep ondervond een behandelingsgerelateerde bijwerking van graad 3 of hoger versus 18% in de GEF-groep. Het tijdelijk stopzetten van de behandeling was noodzakelijk bij 13% in FURMON-groep vs. 16% in de GEF-groep. Het definitief stopzetten vond plaats bij respectievelijk 3% vs. 2%.
De meest frequent voorkomende behandelingsgerelateerde bijwerkingen met FURMON zijn een verhoogde ALT (alanine aminotransferase) (28%), diarree (25%), verhoogde AST (aspartaat aminotransferase) (25%) en uitslag (17%). Een interstitiële longaandoening werd bij één patiënt in elke groep aangetroffen.
Prof. Shi concludeerde dat in de gerandomiseerde, dubbelblinde, fase III-studie FURLONG, furmonertinib geassocieerd kan worden met een significant langere PFS dan gefitinib bij onbehandelde EGFR-gemuteerde NSCLC. Bovendien vertoont furmonertinib een beter veiligheidsprofiel dan gefitinib. Furmonertinib mag dan ook beschouwd worden als de voorkeurseerstelijnsbehandeling bij Chinese patiënten met een EGFR-gemuteerde NSCLC (4).
In haar commentaar op deze studie vroeg prof. Christine Lovly (Vanderbilt University, Nashville) zich af wat de plaats van furmonertinib kan zijn in het huidige drukke landschap van EGFR TKI's van de derde generatie. Op welke manier zullen deze inhibitoren zich onderling differentiëren? Wat met de intracraniale respons? Hebben deze molecules een verschillend veiligheidsprofiel? Zal de prijs/terugbetaling een cruciale rol spelen? En wat met de beschikbaarheid van deze molecules in verschillende gebieden in de wereld? Tabel 1 toont een lijst van de huidig gekende EGFR TKI's in klinische ontwikkeling.
Prof. Lovly stelde dan ook dat we strategieën nodig hebben om de doeltreffendheid van een eerstelijnsbehandeling met EGFR TKI te optimaliseren. Een eerste strategie bestaat erin om in eerste lijn behandelingen te combineren. Een aantal fase II- en fase III-studies met de combinatie van een EGFR TKI en een VEGF/VEGFR (erlotinib/bevacizumab en erlotinib/ramucirumab) hebben een PFS-voordeel aangetoond voor de combinatie. Een OS-voordeel echter werd bij geen enkele van deze combinaties gezien. Daarnaast zijn er ook heel wat tegenstrijdige studies met de combinatie osimertinib (OSI) en bevacizumab (BEV). Een éénarmige fase I-studie met deze combinatie rapporteerde een ORR van 80% met een mediane PFS van 19 maanden (5). In een gerandomiseerde fase II-studie bij patiënten met een EGFR T790M-mutatie zorgde de combinatie OSI + BEV niet voor een verlenging van de PFS noch van de OS (6). Een andere, gerandomiseerde fase II-studie bij behandelingsnaïeve patiënten (n = 122) toonde ook geen verbeterde PFS voor OSI+BEV versus OSI in monotherapie (7). Ook de combinatie van een EGFR TKI met chemotherapie werd of wordt onderzocht. De NEJ009-studie waarbij GEF vergeleken werd met GEF in combinatie met een platinum bevattende chemotherapie. Zowel ORR, PFS als OS waren beter in de arm waar chemotherapie werd toegevoegd. Zo bedroeg de mediane OS 59,9 maanden in de combinatiearm versus 38,8 maanden in de groep met GEF-monotherapie (8). We wachten op de resultaten van de FLAURA 2-studie waar de combinatie van OSI met chemo vergeleken wordt met OSI in mono bij patiënten die nog niet eerder behandeld werden. Verder is er ook nog de combinatie van een EGFR TKI en een 'targeted' therapie. De momenteel lopende fase III-studie MARIPOSA vergelijkt amivantamab plus lazertinib met OSI bij lokaal gevorderde of gemetastaseerde EGFR gemuteerde NSCLC.
Een tweede optimaliseringsstrategie is het gebruiken van een consoliderende lokale behandeling (LCT) bij de aanwezigheid van minimale restziekte (MRD). Een multicentrische, gerandomiseerde studie includeerde patiënten met een stadium IV NSCLC, met hoogstens drie metastasen en geen progressie drie maand of langer na een systemische behandeling in eerste lijn. Patiënten kregen ofwel een onderhoudsbehandeling of werden geobserveerd (MT/O) versus een consoliderende lokale behandeling (chirurgie en/of radiotherapie). De studie werd stopgezet wegens een significant PFS-voordeel voor patiënten in de LCT-arm (14,2 maanden versus 4,4 maanden voor MT/O). Ook voor OS was er een duidelijk verschil in het voordeel van LCT (41,2 maanden versus 17 maanden) (9).
De derde strategie zou er volgens prof. Lovly in bestaan om bij diagnose een verdere genomische stratificatie uit te voeren. Momenteel zijn behandelingsbeslissingen enkel gebaseerd op de aan- of afwezigheid van de EGFR-mutatie (ex19del of L858R). Vraag is of er dieper kan gegraven worden om zo multiple biomerkers te gebruiken bij het nemen van behandelingskeuzes in eerste lijn. Het gelijktijdig voorkomen van de TP53-mutatie is reeds beschreven als een negatieve prognostische factor en wordt geassocieerd met een slechtere afloop. Ook de aanwezigheid van een RBM10-mutatie zou een biomerker zijn voor een slecht responderen op een behandeling met een EGFR-inhibitor. Prof. Lovly maakte terecht de opmerking dat we de ex19del- en de L858R-mutaties na 20 jaar ervaring nog steeds op dezelfde manier behandelen, niettegenstaande er voldoende bewijs beschikbaar is dat deze twee mutaties biochemisch niet identiek zijn. Zo toonde de FLAURA-studie aan dat er geen OS-voordeel was met OSI in de L858R-cohorte, maar wel in de ex19del-cohorte.
Een volgende optimaliseringsstrategie is het gebruik maken van biomerkers met dynamische respons om op die manier patiënten te selecteren waarbij een dosis van de behandeling kan verhoogd worden. Het opklaren van circulerend tumor-DNA (ctDNA) zou een dergelijke dynamische biomerker kunnen zijn, die al bekomen worden drie tot zes weken na het begin van de behandeling. De FLAURA-studie toonde aan dat de PFS voor patiënten waarbij ctDNA na drie weken nog aanwezig was, beduidend minder was dan bij die groep waar een opklaring van ctDNA gezien werd (11,3 maanden vs 19,8 maanden). Ook in andere studies wordt een aanhoudende EGFR ctDNA geassocieerd met kortere duur van behandelen en een mindere OS.
De laatste strategie die door prof. Lovly wordt vermeld, is gebruik maken van alternatieve manieren om de gemuteerde EGF-receptor te targetten. Daarbij denkt ze aan allosteric inhibitors, antibody-drug conjugates, PROTAC's (proteolyse-targeting chimeras), vaccins en aan het gebruik van CAR-T-celtherapie. Kortom, heel wat onderzoek blijft noodzakelijk.
Langetermijnoverlevers in CASPIAN-studie
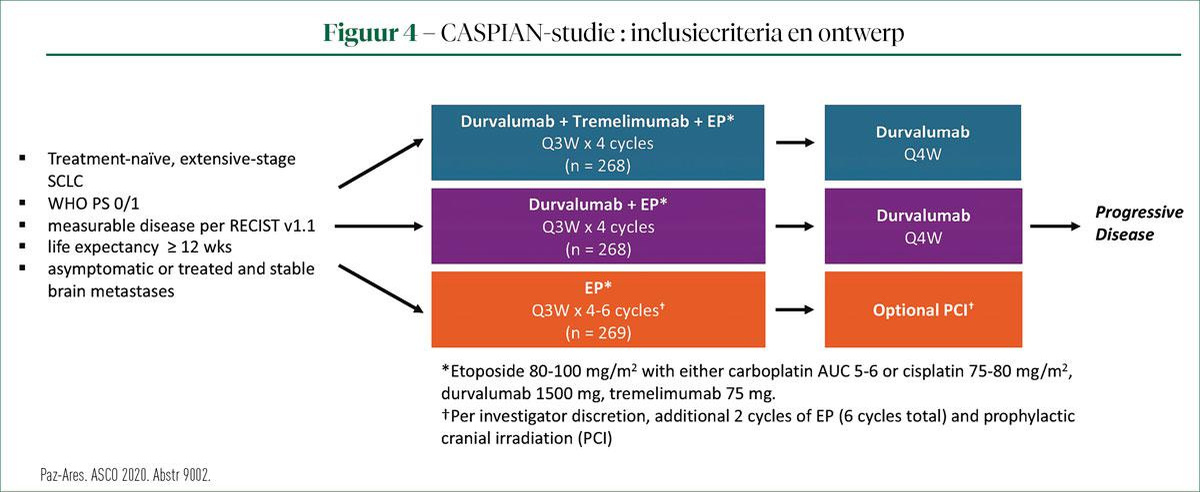
Prof. Niels Reinmuth (Asklepios Longkliniek, München) besprak de resultaten van een post- hocanalyse van de karakteristieken van langetermijnoverlevers in de CASPIAN-studie. Deze fase III-studie vond plaats in de eerstelijnsbehandeling van het kleincellig longcarcinoom in een 'extensive' stadium (ES-SCLC). Inclusiecriteria en ontwerp van de studie worden beschreven in figuur 3.
De studie rapporteerde een significant overlevingsvoordeel voor de eerstelijnsbehandeling met durvalumab (DUR) in combinatie met etoposide + platinum (EP) versus EP bij patiënten met een ES-SCLC. Het overlevingsvoordeel bleef behouden na een mediane follow-up van meer dan drie jaar (11). Ook de combinatie DUR + tremelimumab (TRE) + EP vertoonde een numerieke verbetering van de OS in vergelijking met EP alleen (12). Wat de biomerkers zijn die de werkzaamheid van immuuncheckpointblokkade voorspellen, is bij de behandeling van SCLC nog niet echt bepaald.
De klinische karakteristieken van langetermijnoverlevers werden in deze presentatie besproken.
Langetermijnoverlevers werden gedefinieerd als die patiënten die op het moment van data cut-off (22 maart 2021) nog steeds in leven waren. Zowel in de groep met DUR+EP als in de groep met DUR+TRE+EP waren op dit moment, na een mediane follow-up van 39,4 maanden, nagenoeg driemaal zoveel patiënten nog in leven tegenover in de EP-arm (respectievelijk 16% voor DUR+EP, 14% voor DUR+TRE+EP, 5% voor EP).
Hoewel de LTS-groep in vergelijking met de ITT-populatie een hogere incidentie had van enkele gunstige prognostische kenmerken bij aanvang van de behandeling, bereikten sommige patiënten met hersen- of levermetastasen een langdurige overleving. Patiënten in de LTS-groep hadden meer kans om de EP-inductie (4 cycli of meer) te voltooien, en hadden in de DUR+EP- en DUR+TRE+EP-armen vaker een objectieve respons en een langere PFS dan de ITT-populatie. Vermeldenswaardig is nog dat op de dag van data cut-off nog steeds 44 LTS hun behandeling met DUR verderzetten.
Het uitstellen van de dosis durvalumab was meer nodig bij LTS-patiënten dan in de ITT-populatie. Ondanks een langere blootstelling ondervonden patiënten in de LTS-groep geen toename van ernstige bijwerkingen in vergelijking met de ITT-populatie. De spreiding van deze ernstige bijwerkingen per systeem/orgaanklasse was vergelijkbaar bij de LTS- en de ITT-populatie.
Op de OS-oriëntatiepunten van 18 en 36 maanden werden PD-L1-expressie, tTMB (tissue tumour mutational burden) en de aan- of afwezigheid van de HLA-DQB1*03:01-allel als biomerker geëvalueerd. In de DUR+EP-arm was er geen associatie tussen de aanwezigheid van PD-L1-expressie, tTMB, of HLA-DQB1*03:01 en een OS van > 18 maanden of > 36 maanden. In de DUR+TRE+EP-arm waren PD-L1-expressie (TC of IC ≥1%) en de HLA-DQB1*03:01-aanwezigheid verrijkt bij patiënten met OS groter dan 18 maanden. Dit werd gehandhaafd bij OS groter dan 36 maanden, echter gebaseerd op kleine patiëntenaantallen. Prof. Reinmuth concludeerde dat verder onderzoek nodig is om de mogelijke rol van deze en andere biomarkers in SCLC beter te begrijpen (13).
1. Felip E, et al. Lancet 2021;398:1344-57.
2. Felip E, presentation at ELCC 2022, Proferred Paper Session, # 800.
3. Xingsheng Hu, et al. JCO 2021, Meeting Abstract ASCO 2021.
4. Yuankai Shi, Presentation at ELCC 2022, Proferred Paper Session, # 10.
5. Yu H, et al. JAMA Oncology 2020.
6. Akamatsu H, et al. JAMA Oncology 2021.
7. Kenmotsu H, et al. ESMO 2021 LBA44.
8. Hosomi et al. JCO 2020.
9. Gomez et al. JCO 2019.
10. Ramalingam et al. NEJM 2020.
11. Paz-Ares L, et al. Lancet 2019;394:1929- 39.
12. Goldman JW, et al. Lancet Oncol 2021;22:51 -65.
13. Reinmuth N, presentation at ELCC 2022, Proferred Paper Session, # 1410.