Prof. Margaret Shipp (Dana-Farber Kankerinstituut - Harvard Medical School) besprak op deze boeiende sessie tijdens het Education Weekend van ESMO 2020 de (nog recente) vooruitgang in de zoektocht naar de mechanismen van respons en resistentie op anti-PD-1-therapie bij de klassieke vorm van Hodgkinlymfoom (cHL). Hierbij werden ook de nieuwe resultaten van haar recent onderzoek uitgebreid besproken.
...
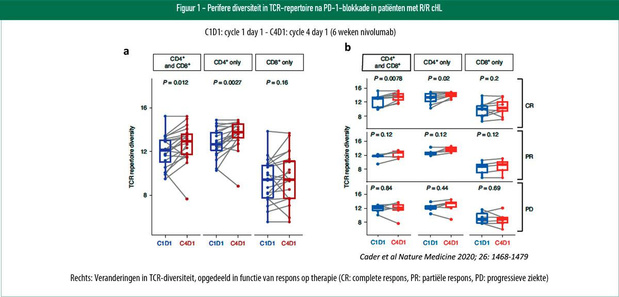
Klassieke Hodgkinlymfomen bevatten kleine aantallen van maligne Hodgkin Reed-Sternberg (HRS) -cellen, binnenin een groot T-celrijk inflammatoir en immuuncelinfiltraat. Ondanks het rijke immuuninfiltraat, was er tot recent weinig bewijs over een effectieve antitumorale immuunrespons. ? 9p24.1 alteraties & PD-L1-expressieIn cHL resulteren alteraties in chromosoom 9p24.1 in een verhoogd aantal kopieën en expressie van PD-L1- en PD-L2, alsook van JAK2. JAK2/STAT-signalering zorgt ook voor een verdere verhoging van PD-L1- en PD-L2- expressie (1,2). Uit verschillende piloot- en registratiestudies bleek er een genetische basis te zijn voor de gevoeligheid tegen PD-1-blokkade. In de fase 2-studie Checkmate-205 werd nivolumab geëvalueerd bij patiënten met recidiverend of refractair (R/R) cHL nà autologe stamceltransplantatie (ASCT), en werd een responspercentage van 65-87% en een verlengde PFS aangetoond (3,4). Gelijkaardige resultaten werden bekomen met pembrolizumab (5,6) waardoor deze twee PD-1-remmers inmiddels zijn goedgekeurd (FDA en EMS) voor de behandeling van R/R cHL. Verdere evaluatie van de tumorbiopsiestalen uit de Checkmate-205-studie toonde aan dat de omvang van 9p24.1-alteraties en de mate van PD-L1-expressie geassocieerd zijn met de respons op PD-1-blokkade en PFS (7). Patiënten met het laagste aantal 9p24.1-alteraties en lagere PD-L1-expressieniveaus bleken minder kans te hebben om progressievrij te blijven na behandeling met nivolumab. ? Andere vorm van antigenpresentatie In eerdere genetische analyses van cHL werden frequente ?2-microglobuline (B2M) inactiverende mutaties, alsook kopieverlies aangetoond, met verstoorde MHC-klasse I- expressie (7,8). Ook waren er veel minder CIITA (MHC II transactivator) inactiverende mutaties (verstoring MHC II-expressie). Kopieverlies van zowel MHC-klasse I- als klasse II-genen werd tevens aangetoond. Aangezien CD8+ T-cellen tumorantigenen herkennen gepresenteerd door MHC-klasse I/B2M-complex, en CD4+ T-cellen tumorantigenen herkennen gepresenteerd door MHC-klasse I, rees de vraag of er een verlaagde expressie van MHC I of II in RHS-cellen mogelijk zou zijn, die bijgevolg een invloed zou hebben op antigenpresentatie aan T-effectorcellen. Uit verdere analyse van de tumorstalen uit Checkmate-205 vertoonde de meerderheid (93%) geen of verminderde expressie van B2M- en MHC-klasse I op RHS-cellen. Expressie van MHC-klasse I op RHS-cellen bleek aldus geen verband te hebben met de effectiviteit van nivolumab. Daarentegen was expressie van MHC-klasse II op RHS-cellen bij patiënten die een volledig heropgebouwd immuunsysteem hadden (>12 m na ASCT), wél voorspellend voor de verlengde PFS (7). Deze resultaten gaven een sterk vermoeden van een alternatief CD4+ T-cel-gemedieerd responsmechanisme op PD-1-blokkade bij cHL. ? Specifieke types responsieve of resistente T-cellen en macrofagenNa verder onderzoek van de tumormicro- omgeving (TME) werd een sterk significante verhoging van PD-1+ CD4+ T-cellen in de onmiddellijke nabijheid van HRS-cellen aangetoond, in vergelijking met CD8+ T-cellen (9). Bovendien werd er in vergelijking met normale reactieve lymfeknopen, een sterk significante expansie van Th1 gepolariseerde T-regulatorische (Treg) en uitgeputte T-effectorcellen (Teff) gevonden in tumorcelsuspensies van cHL (10). Tregs waren PD-1- en Teffs PD-1+, suggererend dat dit aanvullende mechanismen van immuunsuppressie in cHL zouden kunnen zijn. Het team van Shipp heeft zeer recent, in augustus 2020, de resultaten van hun onderzoek naar een perifere immuunsignatuur voor de responsiviteit op PD-1-blokkade gepubliceerd in Nature Medicine (11). Van 56 patiënten met R/R cHL die behandeld waren met nivolumab (Checkmate-205), werden perifere mononucleaire bloedcellen (PBMC's) verzameld zowel vóór (baseline) als tweemaal tijdens de behandeling. PBMC's werden tevens ter vergelijking verzameld van zowel nieuw gediagnosticeerde, eerder onbehandelde cHL-patiënten (n=11), als van gezonde donoren (n=14). Door middel van T-cel-receptorsequencing (TCR) werd het TCR-?-repertoire van PBMC's en sterk gezuiverde CD4+ en CD8+ T-cellen geanalyseerd. Daarnaast werden CD3+ en CD3- immuuncellulaire subsets geanalyseerd d.m.v. time-of-flight cytometrie (CyTOF). ? Baseline TCR-diversiteitDe diversiteit van het TCR-repertoire op baseline bleek significant verlaagd te zijn bij nieuw gediagnosticeerde cHL-patiënten versus gezonde donoren. Bij R/R cHL-patiënten was er een verdere afname van de diversiteit. Opvolgende analyses om het verband van diversiteit in het TCR-repertoire en de respons op nivolumab te onderzoeken, werden beperkt tot patiënten die nivolumab kregen ? 1 jaar ASCT (herstel functionele T-cellen pas na een jaar). De TCR-diversiteit op baseline bleek bij R/R cHL-patiënten sterk voorspellend te zijn voor hun respons op PD-1-blokkade. Patiënten die later een complete respons (CR) verkregen, hadden op baseline een TCR-diversiteit die niet significant verschilde met die van nieuw gediagnosticeerde patiënten. Patiënten met een partiële respons (PR) of progressieve ziekte (PD) na nivolumab hadden op baseline echter een beduidend lagere diversiteit. Gelijkaardige resultaten werden verkregen na analyse van baseline TCR-diversiteit van sterk gezuiverde, perifere CD4+ en CD8+ T-cellen. Vervolgens werden dynamische veranderingen in de TCR-repertoire nagegaan na PD-1-blokkade. Op zes weken behandeling met nivolumab was er een sterk significante stijging in CD4+ TCR-repertoire diversiteit, maar niet in die van CD8+ (figuur 1). De stijging was bovendien het meest uitgesproken bij patiënten die een CR bereikten. Deze resultaten duiden op de rol van de CD4+ T-cel-as in de respons op anti-PD-1-therapie bij cHL. ? Klonale T-celexpansie na anti-PD-1De onderzoekers evalueerden hierna de expansie van klonale T-cellen tijdens therapie. Ze identificeerden meer dan vier miljoen unieke TCR-sequenties op baseline, waarvan bijna 800.000 een minstens verdubbelde expansie hadden na anti-PD-1. Er werd gekeken naar twee klonotypes: singletons (1 kopie pre-behandeling) en non-singletons (? 2 kopieën pre-behandeling). De onderzoekers redeneerden dat singleton TCR-klonen wellicht naïeve- of centraal geheugen (CM)-T-cellen voorstelden. Na vergelijking van het aantal singleton klonen met de CyTOF-bepaalde differentiatiestatus van de perifere T-cellen, had het aantal singleton klonen in alle T-cellen, alsook in CD4+ en CD8+ T-cel subsets, een grotere associatie met naïeve- en CM-T-cellen en waren deze klonen wellicht niet terminaal gedifferentieerd. Vervolgens werd het verband tussen de expansie van elk klonotype (singleton vs. non-singleton) met de respons op PD-1-blokkade nagegaan. Patiënten die een CR bereikten, bleken op zes weken therapie (nivolumab) een significant verhoogde expansie van singletons versus non-singletons weer te geven, in vergelijking met patiënten die een PR of PD verkregen. Dit suggereerde dat eerder de klonale expansie van minder gedifferentieerde singletons geassocieerd was met een gunstig respons op PD-1-blokkade in cHL. ? CD3+ en CD3- perifeer immuunsignatuurIn vergelijking met gezonde donoren en patiënten met nieuw gediagnosticeerde cHL, hadden patiënten met R/R cHL op baseline beduidend minder perifere CD3+ naïeve T- cellen en een groter aantal gedifferentieerde CD4+ en CD8+ effectorcellen, die voornamelijk PD-1+ waren, met hogere relatieve PD-1-expressieniveaus. In R/R cHL onderling, hadden patiënten met een hoger aantal naïeve T-cellen op zes weken behandeling echter een gunstigere respons op anti-PD-1-therapie. Deze bevindingen, samen met de responsgeassocieerde verschillen in diversiteit in TCR-repertoire en singleton klonale T-cel-expansie tijdens behandeling, geven wellicht een aanhoudend vermogen om nieuwe immuunresponsen te ontwikkelen weer. Tenslotte werden ook perifere CD3-subsets geanalyseerd. Opvallend was dat in vergelijking met gezonde donoren, nieuw gediagnosticeerde patiënten een significante verhoging van het aantal klassieke monocyten vertoonden, alsook een drastische verlaging in circulerende B-cellen én in circulerende natural killer cells (NKC's) in alle stadia van differentiatie (figuur 2). De R/R cHL-groep had gelijkaardige aantallen op baseline als die van nieuw gediagnosticeerde patiënten. Wanneer de CD3-subsets op baseline bij R/R-patiënten echter onderling werden geanalyseerd, werd duidelijk dat zij die een CR bereikten, een CD3-perifere immuunsignatuur vertoonden die meer op die van gezonde donoren leek, zowel wat betreft de monocyten, B-cellen en de meest actieve (mature) vorm van NKC's (figuur 2). Dit laatste was interessant, omdat bepaalde inhibitorreceptoren op NKC's interageren met MHC klasse I. Als deze klasse ontbreekt, zou men theoretisch gezien een meer actieve NKC-populatie kunnen hebben. Shipp benadrukte dan ook dat de respons op PD-1-blokkade het meest gunstig was bij patiënten die de hoogste niveaus aan actieve (mature) NKC's op baseline hadden. Ook waren de onderzoekers geïnteresseerd in bijkomende, aangeboren, potentieel cytotoxische populaties, gezien de onwaarschijnlijke rol van CD8+ cytotoxische T-cellen in cHL. Ze identificeerden een additioneel circulerende Granzyme B-positieve (GrB+) populatie met macrofaagmarkers: CD68+GrB+. Deze was groter in gezonde donoren versus nieuw gediagnosticeerde patiënten, en groter in patiënten (op baseline) die een gunstiger respons verkregen op nivolumab. De subset was tevens detecteerbaar in de TME van recidiverende cHL's. Shipp concludeerde dat hun onderzoeksresultaten een potentieel complementaire rol hebben blootgesteld van nieuw uitgebreide, klonaal diverse CD4+ T-cellen en additionele aangeboren effectorcellen, in de respons op PD-1-blokkade. Deze nieuwe inzichten kunnen leiden tot de identificatie van predictieve biomerkers en andere therapeutische doelwitten die men kan evalueren samen met PD-1-blokkade bij cHL en andere tumoren.