Eerder dit jaar ontving prof. dr. Ludo Van Den Bosch de Prijs Generet voor Zeldzame Ziekten. Deze prijs wordt beheerd door de Koning Boudewijnstichting. Er is een bedrag van één miljoen euro aan gekoppeld, waarmee dit de meest prestigieuze prijs voor zeldzame ziekten is in België.
...
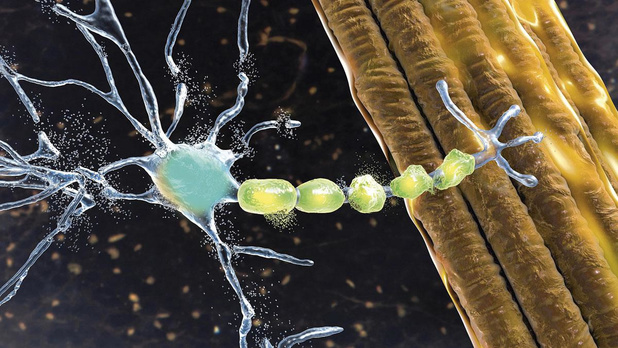
Prof. dr. Ludo Van Den Bosch bestudeert al vele jaren de onderliggende mechanismen van ALS (amyotrofische laterale sclerose) in het Laboratorium voor Neurobiologie van de KU Leuven/VIB, het Belgische referentiecentrum voor de studie naar ALS. Zijn onderzoek gebeurt in nauwe samenwerking met prof. dr. Philip Van Damme, neuroloog in het UZ Gasthuisberg, en met de ALS Liga België. Bij ALS sterven selectief de motorneuronen af die in verbinding staan met de spieren. Als gevolg daarvan verliezen mensen met ALS geleidelijk de controle over hun spieren tot ze volledig verlamd zijn en niet meer kunnen spreken en ademen.Hoe bent u in dit onderzoeksdomein terechtgekomen? Als bioloog ben ik mijn carrière begonnen in het labo van prof. Robberecht, die het klinisch en wetenschappelijk ALS-onderzoek aan de KU Leuven had geïnitieerd; een vijftal jaar geleden ben ik verantwoordelijk geworden voor het labo, dat nu zo'n 35 medewerkers telt. Bij ALS is het axonaal transport langs de uitlopers (sommige tot een meter lang) van het cellichaam naar de spieren verstoord. We hebben ontdekt dat een verstoord axonaal transport kan worden hersteld door het enzym HDAC6 selectief te inhiberen (gepubliceerd in Nature Medicine). Om de verdere ontwikkeling van deze therapeutische strategie te verzekeren, hebben we in 2019 een spin-off gecreëerd, Augustine Therapeutics. Welke modellen gebruikt u voor uw onderzoek? Wij werken in de eerste plaats met induced Pluripotent Stem Cells (iPSCs). Vanuit huidcellen van patiënten met familiale ALS worden stamcellen gegenereerd die dan verder kunnen gedifferentieerd worden tot motorneuronen. Wanneer we deze motorneuronen kweken in combinatie met spiercellen kunnen we ook de neuromusculaire juncties bestuderen. Met de CRISPR/Cas9-techniek corrigeren we de mutaties die ALS veroorzaken en vervolgens kunnen we de gecorrigeerde lijn met de mutante lijn vergelijken. Het is spectaculair om te zien hoe de verschillen tussen de twee groepen kunnen worden gecorrigeerd met een HDAC6-inhibitor.Welke genmutaties zijn belangrijk bij ALS? Bij 90 procent van de patiënten is de oorzaak van de ziekte onbekend (sporadische ALS) en bij de overige 10 procent is ze genetisch bepaald (familiale ALS). De eerste genmutatie in ALS, in het SOD1-gen, is 30 jaar geleden gevonden. Ondertussen zijn er nog een 20-tal andere gendefecten ontdekt waarvan de drie belangrijkste in de genen die coderen voor TDP-43, FUS en C9orf72.Ons onderzoek bestudeert de vier belangrijkste mutaties en het is interessant om te zien dat het effect van de HDAC6-inhibitor niet beperkt is tot de motorneuronen met een specifieke mutatie. In nieuw onderzoek werken we nu ook met huidcellen van patiënten met sporadische ALS, aangezien de iPSC-technologie ons nu voor de eerste keer een model geeft voor de sporadische vorm van de ziekte. Hoewel deze patiënten geen gekende mutatie hebben, zijn er wel aanwijzingen dat er in sommige gevallen ook een genetische component is. Wat is de huidige klinische behandeling voor ALS? In België krijgen alle ALS-patiënten riluzole. Dat middel inhibeert de glutamaatvrijstelling en heeft een effect op de signaaloverdracht tussen neuronen. Er is aangetoond dat riluzole de overleving bij ALS verlengt met drie tot zes maanden, hoewel patiënten weinig klinische effecten ervaren. Zoals bij kanker hoopt men in het ALS-veld dat verschillende medicaties met een gelijkaardig therapeutisch effect als riluzole zullen gecombineerd kunnen worden, waardoor er ook voor de patiënt een duidelijk effect merkbaar zal zijn. Op dit ogenblik zijn enkel in Leuven al meer dan tien klinische trials bezig - zo'n groot aantal hebben we nog nooit voordien gezien. In dat verband is de recente goedkeuring op 25 april door de FDA van tofersen heel goed nieuws, ook omdat dit aangeeft dat sommige vormen van ALS niet langer als ongeneeslijk moeten worden beschouwd. Tofersen is een antisense oligonucleotide dat de synthese van het SOD1-proteïne vermindert en bijgevolg de oorzaak van ALS wegneemt bij die patiënten die een mutatie in het SOD1-gen hebben. Men zag een duidelijke daling van het Neurofilament Light Chain (NfL, een bestanddeel van het cytoskelet), een biomarker van zenuwcelbeschadiging. Spijtig genoeg was er geen statistisch significant effect op het klinisch eindpunt, wat waarschijnlijk toe te schrijven is aan de relatief korte duur van de behandeling. De open-label-extensie van de studie toonde echter wel een zeer overtuigende verbetering bij de patiënten, wat ook de FDA overtuigde. De beslissing van het EMA wordt verwacht in het najaar.